最近的研究表明,环状RNA(circRNA)介导的RNA结合蛋白(RBP)翻译后修饰在肝细胞癌(HCC)的转移中起着关键作用。然而,尚不清楚其潜在作用机制和的临床治疗意义。
2024年2月15日,浙江大学徐骁及Chen Ronggao共同通讯在Advanced Science 在线发表题为“Integrated Multiomics Reveals Silencing of has_circ_0006646 Promotes TRIM21-Mediated NCL Ubiquitination to Inhibit Hepatocellular Carcinoma Metastasis”的研究论文,该研究使用多组学方法描绘circRNA和RBP的调控网络。Has_circ_0006646(circ0006646)是一种未报道的HCC circRNA,与预后不良相关,circ0006646沉默能够明显抑制体内转移。
从机理上讲,circ0006646阻止了核仁素(NCL)与含有E3连接酶三方基序21之间的相互作用,从而减少了蛋白酶体通过K48连接的多泛素化作用介导的NCL降解。此外,研究证明NCL表达的变化会影响多种蛋白质的磷酸化水平并抑制p53翻译。用于模拟临床治疗的患者来源的肿瘤异种移植物和慢病毒注射证实了该靶点的潜在治疗价值。总体而言,该研究描述了circRNA介导的NCL泛素化降解在HCC转移中的综合多组学景观,并提供了一个新的治疗靶点。

肝细胞癌(HCC)占原发性肝癌的75-85%,是第六大最常诊断的癌症,并被公认为全球癌症相关死亡的第三大原因。尽管过去的70年中,化疗、靶向药物、免疫疗法以及手术切除和肝移植(LT)等系统疗法发展迅速,但HCC的5年生存率仍不容乐观。转移、复发或对治疗耐药共同决定了HCC的死亡率。转移是肿瘤细胞在全身的系统性扩散和增殖,在很大程度上直接影响实体瘤患者的5年生存率(5-30%)。微血管浸润(MVI)会损害手术治疗效果,被认为是转移的起始阶段。因此,破译MVI发生的分子机制尤为重要。
进一步研究发现,基因突变不足以解释肿瘤的发生。对表观遗传因子(如非编码RNA(ncRNA))的深入了解揭示了肿瘤发生过程的另一个重要环节。环状RNA(circRNA)由内含子、外显子和其他转录产物的顺式反向剪接和环化形成,构成共价闭合的单链环,被认为是新兴的ncRNA。越来越多的证据表明,在HCC转移过程中,circRNA是一把双刃剑,如circRPN2通过miR-183–5p/FOXO1轴抑制HCC转移,而circASAP1介导肿瘤相关巨噬细胞浸润以促进肺转移。此外,目前在研究circRNAs在转移过程中发挥的作用方面,更多地集中在转移的晚期阶段,如肺转移,而忽略了早期阶段。因此,尚不清楚MVI中circRNA的生物学功能。
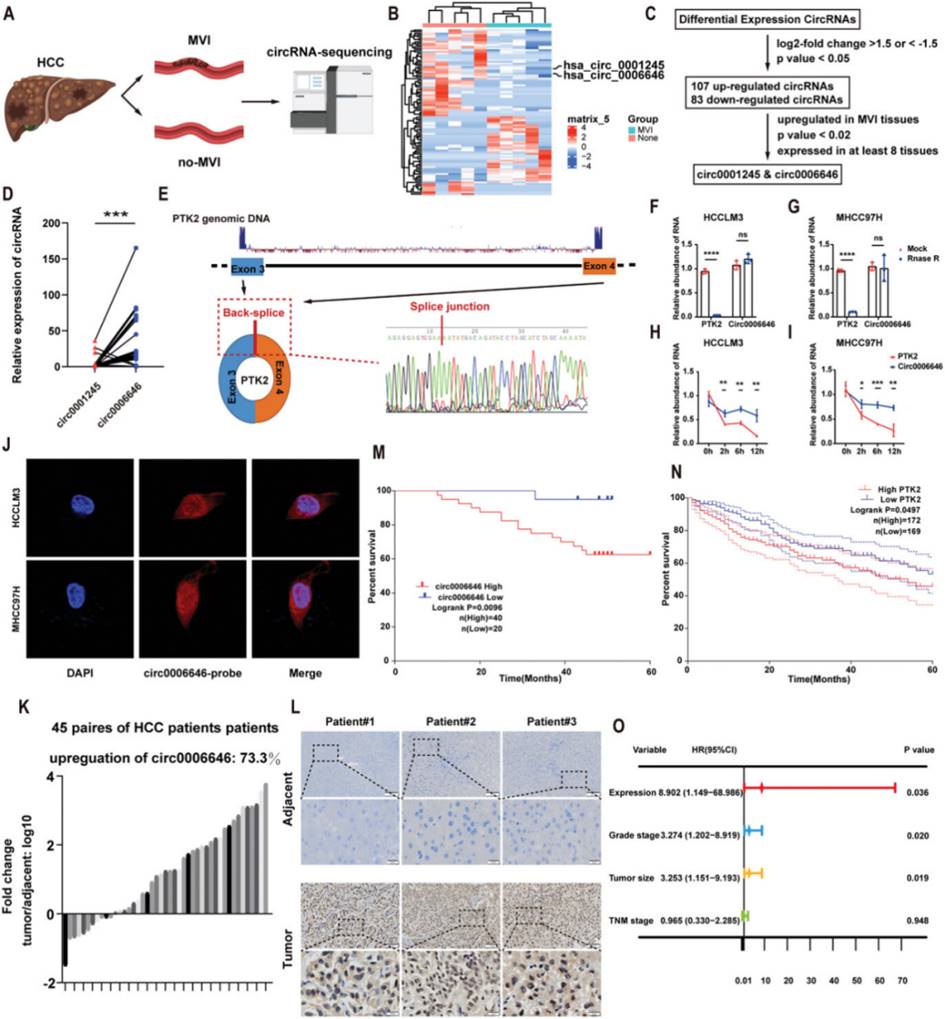
Circ0006646 在HCC中上调(摘自Advanced Science )
核仁素(NCL)是核仁中含量最丰富的蛋白质之一,与核糖体RNA(rRNA)转录和核糖体组装有关。NCL是一种天然的核酸结合靶点,许多研究证实NCL与肿瘤的发生和发展高度相关。不仅在蛋白质层面,还包括翻译后修饰(PTM)、亚细胞定位的变化(特别是在细胞质和细胞膜中)以及DNA损伤的调节等,都可能影响肿瘤的进展。尽管有研究报道了ncRNA和NCL在其他疾病中的调控网络,但仍不清楚circRNA介导的NCL变化调节肿瘤发生(特别是在HCC中)的机制,需要进一步探索。
该研究证明has_circ_0006646(circ0006646)是一种未报道的转移相关circRNA,在HCC细胞和组织中上调,是长期存在的危险因素,在体内和体外促进HCC的侵袭和迁移。从机制上讲,circ0006646可以阻止NCL与E3连接酶三方基序21(TRIM21)之间的相互作用,从而减少NCL的泛素化降解。最后,作者使用患者来源的肿瘤异种移植(PDX)模型进一步验证了circ0006646的治疗价值。综上所述,该研究拓展了对HCC转移表观遗传调控背景的认知,为临床治疗提供了参考。
参考消息:https://onlinelibrary.wiley.com/doi/10.1002/advs.202306915













